易基因|植物中m6A甲基化酶调节机制:组成、功能和进化
作者:互联网
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
N6‐methyladenosine也就是我们平时所说的m6A甲基化修饰,是RNA最关键的内部修饰之一,是真核生物丰富和调节遗传信息的一种保守的转录后机制。这种修饰在植物中的范围和功能一直是研究的热点,特别是在模式植物系统中。与哺乳动物一样,植物中也存在m6A甲基化转移酶(writers)、去甲基化酶(erasers)和甲基化阅读蛋白(readers),这些蛋白的特征及功能是当前植物学研究中新的方向。今天,就为大家分享一篇在PBJ上发表的一篇关于植物m6A的综述,分析总结了近几年来,植物m6A相关甲基化酶结构与成分,以及这些酶在植物发育生物学、逆境胁迫应答等方面的生物学功能。作者认为,从进化角度来看,不同植物中这些m6A甲基化酶都高度保守。
在转录后修饰中,m6A是最普遍的修饰之一,广泛存在于tRNA、rRNA、mRNA、miRNA、lncRNA和circRNA中。值得注意的是,在真核细胞中,m6A修饰在所有RNA碱基修饰中占比达到80%,在polyA mRNA中m6A在所有RNA碱基修饰中占到的比例也超过50%。在植物和其他真核生物中,m6A修饰是由m6A甲基转移酶在与RNA上的保守motif RRACH(R=G/A; H=U/A/C)结合后产生的。m6A修饰频率在RNA中分布不是特别均匀,在成熟的mRNA中丰度较高。
在植物中,除了3’UTR和TES,部分样本在5’UTR和TSS附近也存在大量m6A修饰富集。超过60%的m6A修饰位于叶绿体相关蛋白基因的TSS附近,在测序结果中某些光合作用的相关基因也存在大量的m6A修饰。这些结果表明m6A修饰参与调控了光合作用。
迄今为止,m6A的研究大多集中在人类和其他哺乳动物中,而很少有关于植物m6A的论文。此外,许多关于人类和其他哺乳动物中的m6A文章得出的结论在植物中受到了挑战。
本文首先对22种植物中的m6A writers和erasers进行鉴定,总结在植物中RNA甲基化酶的组成和结构。由于m6A在不同物种中高度保守,选择拟南芥作为模型来确定其他植物物种的同源蛋白,以揭示m6A修饰潜在的分子机制。其次,系统地综述了近年来植物m6A甲基化生物学功能的研究进展。最后,研究了不同植物之间m6A甲基化酶之间的关系,描述了m6A在植物中甲基化酶的功能和进化,有助于更好地理解m6A的功能,有助于揭示RNA修饰调控机制的复杂性。
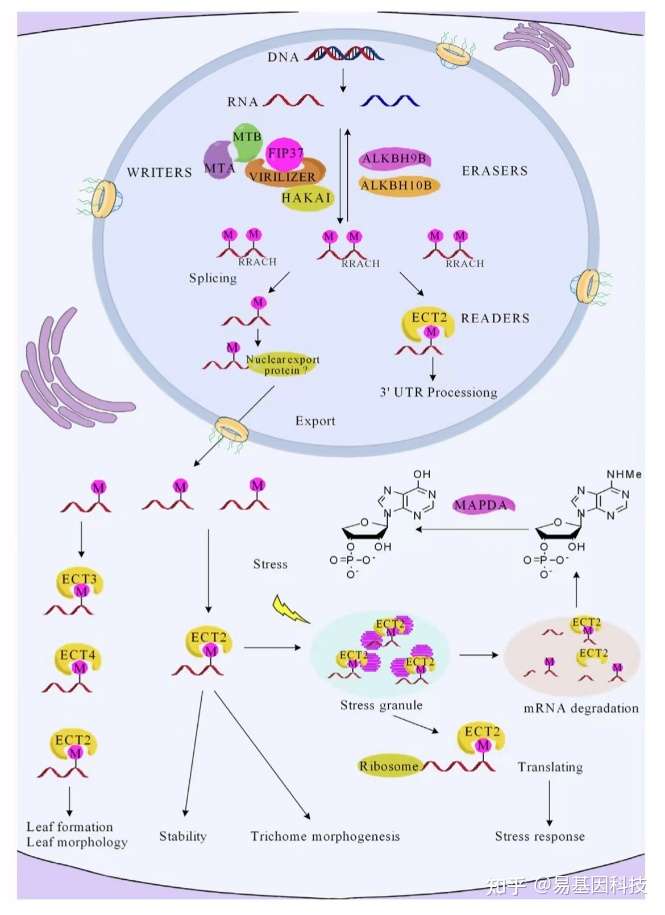
植物m6A甲基化酶:writers、erasers和readers
m6a-writer复合物包括蛋白质MTA、MTB、FIP37、virilizer和HAKAI。核内的ALHBH9b和ALKBH10b蛋白可以去除m6A修饰。ECT2/3/4和CPSF30蛋白作为m6A阅读蛋白,专门结合含有RRACH motif的m6A位点并介导特定功能。m6A甲基化在mRNA代谢、翻译和稳定性中的重要作用已经被发现。ECT2调节核内的3′UTR mRNA处理。然而ECT2在细胞质中可以结合到含m6A的RNA,以促进mRNA的翻译,并将mRNA导入应激颗粒,以提高应激耐受性。另两个阅读蛋白ECT3/4可能调控拟南芥叶片的形态发育。最后,通过酶MAPDA催化N6-MAMP转化为IMP,可以将RNA中的m6A修饰转化为N6-mAMP。
m6A甲基化转移酶是在转录后由保守motif RRACH的一类RNA结合蛋白形成复合物组成。m6A甲基化、去甲基化以及识别过程中涉及到许多蛋白,包括writers、erasers和readers。在拟南芥中writers包括MTA、MTA,erasers包括ALKBH9b、ALKBH10b,readers包括ECT2、ECT3和ECT4等。因为m6A水平远远低于RRACH motif丰度,所以并不是所有RRACH motif都与m6A修饰相关,这表明调节m6A修饰的分子机制尚未被完全挖掘。更好地理解拟南芥m6A修饰的分子机制将为进一步了解植物中的m6A加工过程以及其他模型系统提供依据。
m6A Writers
在哺乳动物中鉴定的第一个m6A甲基转移酶被命名为METTL3,并从200kDa甲基转移酶复合物中被成功克隆出来。METTL3是S-腺苷-L-蛋氨酸(SAM)依赖性甲基转移酶家族的一个成员,在植物和哺乳动物中高度保守。MTA(METTL3人同源蛋白)是拟南芥中最早发现的甲基转移酶之一。进化分析以及实验均表明,METTL14蛋白是人类催化m6A RNA甲基化的第二个最活跃的m6A甲基转移酶,与METTL3高度同源,但METTL14没有甲基转移酶活性。在通过氢键与METTL3相互作用形成非常稳定的二聚体之前,METTL14在结合RNA底物方面发挥了重要作用。拟南芥中已经鉴定出MTB(METTL14人类同源蛋白),但其功能仍未知。
Pre-mRNA剪接调节因子WTAP的缺失也可能导致mRNA整体m6A水平显著降低,这表明WTAP是甲基化转移酶复合物的第三个主要蛋白。m6A甲基化复合物的第四个关键蛋白KIAA1429是通过敲除突变鉴定出来的,这个蛋白缺失会导致哺乳动物mRNA整体m6A水平显著降低。Virilizer是果蝇体内的同源蛋白,通过调控整体m6A水平控制性别分化,被认为是m6A甲基化复合物的第五个蛋白。在拟南芥中,Virilizer(KIAA1429人类同源蛋白)和E3泛素连接酶HAKAI(HAKAI人类同源蛋白)分别被发现是甲基化转移酶复合物的第四个和第五个关键蛋白。
m6A Erasers
在哺乳动物中,首次发现m6A去甲基酶——FTO(fat mass and obesity‐associated protein)。FTO以α-酮戊二酸和二价铁离子Fe2+依赖方式催化m6A修饰的腺苷转化为不带m6A修饰的腺苷,这表明m6A是一种可逆的动态修饰。第二种m6A去甲基化酶是ALKBH5(alkylation repair homolog 5, 烷基化修复同系物5)是FTO一样都是Alkb家族的同源蛋白。乳腺癌细胞中ALKBH5蛋白的表达升高与m6A整体水平的降低有直接关系。当底物为m6A修饰的RNA时候时,ALKBH5具有催化活性使腺嘌呤上的m6A修饰被去除,但是ALKBH5对未发生m6A修饰的腺嘌呤本身没有催化活性,这表明ALKBH5是一种m6A去甲基酶。
已有研究揭示了拟南芥m6A去甲基化的过程由ALKBH9b和ALKBH10b介导,尽管去甲基酶家族在其他植物物种中的存在和作用机制尚不清楚。
m6A readers
为了了解m6A相关基因表达调控的分子机制,m6A阅读蛋白的功能至关重要。这些阅读蛋白与m6A修饰的RNA能够特异结合,实现甲基化修饰的生物学功能。需要注意的是,m6A阅读蛋白不参与腺嘌呤上N6的甲基化和去甲基化的作用,而是与m6A的RNA结合后进一步发挥功能。YTHDF2和YTHDF3是由Gideon Rechavi课题组在2012的Nature中首次报道。YTH家族成员高度保守,包含一个芳香口袋的YTH结构域,用于识别m6A修饰的碱基。这些蛋白质广泛存在于人类、果蝇、酵母和拟南芥中。此外,不同的m6A阅读蛋白可以产生不同的功能。
因此,这些甲基化转移酶、去甲基化酶和甲基化阅读蛋白的识别、分类和特征将有助于建立属于植物生物学中独有的m6A调控途径。
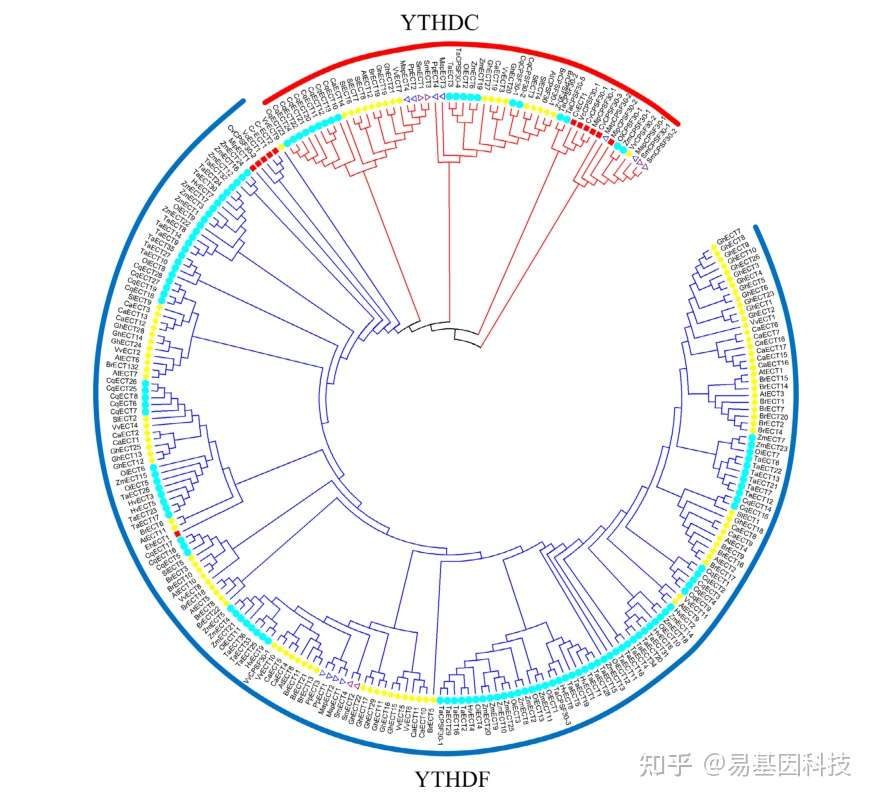
植物中m6A的功能描述与简介
m6A与mRNA加工
由于拟南芥拥有比较完整的突变体库,所以在研究m6A的模式植物上是最佳选择。关于植物中m6A修饰或m6A相关酶的机制与功能研究仍然数量较少。首先,m6A被认为是最重要的RNA修饰之一,无论是mRNA降解、稳定性、翻译还是小RNA加工都与m6A修饰相关。ECT2蛋白作为YTHDF2人同源蛋白,不仅调控核内的3′UTR加工,还通过结合带有m6A修饰的碱基,在促进mRNA稳定和控制胞质内的mRNA命运中起着关键作用。最近的研究发现5′ UTR的m6A修饰可以影响蛋白质的翻译效率。第一个证据来自热休克应激反应的研究,从而导致m6A修饰的重新分布,使得5′ UTR区域内的m6A修饰比例增加,并在应激条件下促进蛋白质翻译。
此外,m6A修饰在mRNA上不同部位也能对翻译机调控制产生明显的影响。例如,eIF4E是翻译启动的关键蛋白。mRNA上3′ UTR有m6A可以招募阅读蛋白YTHDF1,通过与eIF4E/eIF4G/eIF3之间建立联系,将43s启动前复合体招募到5′cap,从而促进依赖cap的翻译。
m6A在植物发育中的作用
m6A修饰被认为在植物胚胎发育中起着关键作用。m6A甲基化转移酶在胚胎后表达水平降低,包括MTA、MTB、FIP37、Virilizer和HAKAI,导致m6A整体水平显著减少。这些m6A writers的表达降低或敲除产生了不同的分化表型,包括毛状枝、缺陷叶萌生、营养枝顶端分生组织过度增殖,最终导致胚胎致死。
ECT2的敲除增加了毛状体分支,表明ECT2对调节毛状体分支的发育至关重要。ALKBH10b的敲除导致开花延迟,也抑制了营养生长,表明ALKBH10b介导的mRNA去甲基化修饰影响mRNA转录的稳定性继而影响成花转变。
某些m6A相关基因在调控愈伤组织中转录因子活性方面起着不可或缺的作用,而其他m6A相关基因则与叶绿体以及类囊体功能相关。此外,N6‐mAMP脱氨酶(MAPDA)将N6‐mAMP分解为IMP,这可能与根系发育有关,因为MAPDA的敲除会导致根系生长速度略有下降。
m6A在胁迫刺激下应激反应
越来越多的研究表明m6A也参与调节对各种非生物(abiotic)和生物胁迫(biotic stress)的反应。不同的细胞应反应可导致m6A在转录层面重新分布,导致m6A与5′UTR区域整体m6A水平的增加。5′ UTR上的m6A修饰以一种不依赖帽子结构的方式来指导eIF3E的结合,以促进哺乳动物mRNA在热应激下的翻译启动机制。在植物中,许多研究揭示了m6A对应激反应的动态分子调控机制。ECT1和ECT2与应激反应蛋白CIPK1(Calcineurin B‐Like‐Interacting Protein Kinase1)能够特异性互作,并在不同外部条件刺激下,将钙信号传递到细胞核中。
其他研究还证实,在病原微生物的胁迫下,植物的m6A整体水平出现上升。也有研究表明基因上发生m6A位点在正常水稻组织以及人和小鼠之间高度保守。然而,一些m6A修饰位点在mRNA的区域也可能表现出物种特异性、细胞特异性或应激特异性调节。例如,与叶片相比,水稻愈伤组织中发生m6A修饰的基因及发生修饰的mRNA上的具体区间(如TSS、TES、3’ UTR及5’ UTR等)具有组织特异性。如此看来m6A修饰似乎是控制基因表达、植物发育和生理过程的有效植物调控策略。
m6A甲基化酶在植物中的进化
为了了解m6A三种甲基化酶的进化历史和相互关系,文章分析了22个代表性植物中m6A甲基化转移酶。结果表明,在高等植物中,m6A writers的数量比低等植物中要多,这表明高等植物可能需要更精确的m6A修饰调控机制,以应对复杂多变的环境。值得注意的是,m6A甲基化转移酶在外果皮中没有被鉴定出来。除变种的小球藻和莱茵衣藻外,蕨类植物物种和藻类物种均不含病毒和HAKAI相关蛋白。有趣的是,异源六倍体小麦中拥有数量最为庞大的m6A甲基化转移酶。按照目前研究来看,仅有拟南芥目前有少量的m6A甲基化转移酶报道。如若对植物中m6A甲基转移酶复合物开展鉴定,将有助于理解植物中m6A修饰发挥的巨大功能。
为了研究m6A甲基化转移酶在保守的核心结构域上的进化关系,作者预测MTA、MTB、FIP37和Virilizer中的保守蛋白结构域。
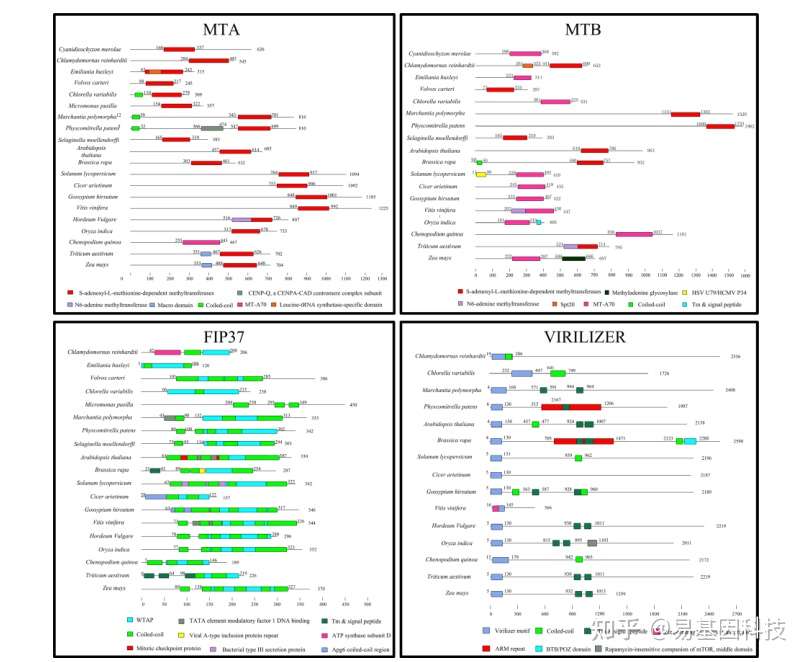
大多数MTA成员具有一个SAM(S-腺苷甲硫氨酸)甲基转移酶结合域,除藜麦外在所有研究物种中都高度保守。此外,所有物种中的MTB蛋白也包含一个SAM甲基转移酶结合域或SAM结合位点MTA70,这是具有甲基化催化活性的结构域。所有FIP37蛋白都包含一个WTAP结构域。结果表明所有植物中,m6A甲基化转移酶一些关键区域的蛋白质序列和结构域都高度保守。
总结
在本文中,作者系统地回顾了植物m6A甲基化酶的蛋白结构、组成、功能和进化。对这些m6A相关蛋白的氨基酸序列进行比较研究后,将有助于理解m6A修饰的动态过程及其功能作用,并加深我们对m6A如何在植物中发挥RNA表观遗传调控的理解。
参考文献:doi: 10.1111/pbi.13149
相关阅读:
干货:m6A RNA甲基化MeRIP-seq测序分析实验全流程解析
项目集锦 | 易基因近期m6A甲基化(MeRIP-seq)研究成果
项目文章 | 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
独家分享:m6A peak鉴定经典点软件exomPeak原理解析
植物中m6A甲基化酶调节机制:组成、功能和进化

标签:甲基化酶,甲基化,RNA,基因,m6A,mRNA,修饰,蛋白 来源: https://www.cnblogs.com/E-GENE/p/16454175.html