易基因|Science:单细胞甲基化测序鉴定哺乳动物的新神经元亚型和调节元件
作者:互联网

神经元,又称神经细胞,是构成神经系统结构和功能的基本单位。通常情况下,哺乳动物的神经元类型是通过它们的结构、电生理学和连接性来识别的。因此,科学家们希望找到一种分子方法来直接鉴定出具有不同功能的神经元群体。早在2017就有科学家在Science上发表了一篇利用单细胞甲基化技术鉴定不同神经元类型的文章(Single-cell methylomes identify neuronal subtypes and regulatory elements in mammalian cortex)(IF:47.728),以下是文章分享。
摘要
哺乳动物的大脑包含不同的神经元类型,但目前科学界缺乏能够识别和表征它们的单细胞表观基因组分析。众所周知,DNA甲基化是一种稳定的表观遗传标记,用于区分细胞类型和标记调控元件。作者从单个神经元细胞中发现了超过6000个甲基化组,并用它们识别了额叶皮层中16个小鼠和21个人类的神经元亚群。DNA甲基化表现出了不同细胞类型的特有分布。因此,作者确定了不同神经元类型甲基化的调节元件。作者还观察到抑制神经元的调节元件比兴奋性神经元具有更强的跨物种保守性。单细胞甲基化组不光扩大了脑细胞类型,还确定了脑细胞多样性跨物种保守的调节元件。
从降生的那一刻开始,生命体大脑中的神经元会在非CG位点积累大量的DNA甲基化(mCH)和CG位点甲基化(mCG)。mCG和mCH在基因组、启动子和增强子上的模式是不同神经元类型所特有的。有研究发现,基因组mCH比mCG或染色质可及性能更好的预测基因表达。因此,利用单细胞神经元甲基化测序可以精确检测超过90%的基因组mCH水平。
结果
首先,作者设计了一种单细胞甲基化测序(single nucleus methylcytosine sequencing,snmC-seq)方案,将其应用于青年小鼠(8周)和人类(25岁)额叶大脑皮层(FC)的神经元(图1A)。流式细胞荧光分选术(FACS)从人FC和解剖的小鼠FC的浅、中、深层分离出标记NeuN抗体的单个神经元细胞。作者从小鼠的样本中分离出了3377个小鼠神经元,从人的额叶皮层中分离出2784个神经元并进行甲基化测序 (图1,B和C)。
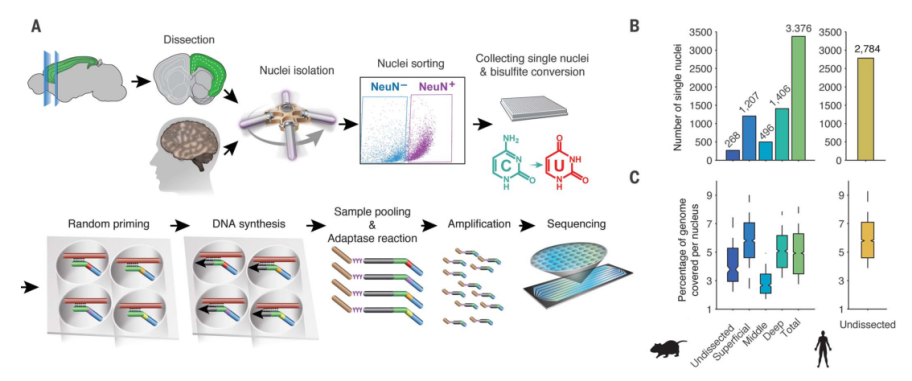 图1 高通量单细胞甲基组测序(snmC-seq)小鼠和人额叶皮层(FC)神经元
图1 高通量单细胞甲基组测序(snmC-seq)小鼠和人额叶皮层(FC)神经元
接着,作者利用他们开发出的snmC-seq的方法对小鼠和人类皮质神经元进行甲基化测序,将得到的数据用相同的参数聚类,识别出了16个小鼠和21个人类神经元簇(图2,A到D)。假设基因组mCH与基因表达之间呈反向关系,作者根据已知的皮质谷氨酸或GABA能神经元标志物(例如Satb2、Gad1、Slc6a1)、皮质层标志物(例如Cux2、Rorb、Deptor、Tle4)或抑制性神经元亚型标志物(例如Pvalb、Lhx6、Adarb2)的mCH降低来注释每个簇(图2,E和F)。对于大多数簇,多个标记基因上的mCH耗尽允许作者分配簇标签来指示假定的细胞类型。例如,作者在Rorb (图2E)发现了一群mCH超低的小鼠神经元,这是L4和L5a兴奋性锥体细胞的已知标记。将这一信息与Deptor等标记相结合,作者通过species和layer (例如,mL4代表小鼠L4)标记了L5而不是L4神经元。类似地,作者也使用了经典的抑制性神经元的标志物,如Pvalb来标记相应的簇。整合的单核苷酸甲基组显示出与匹配细胞群体的整体甲基组相一致的mCH和mCG图谱。单细胞甲基化组(图2G)的小鼠和人类皮质中每个主要细胞亚型的神经簇分类与基于单细胞RNA测序具有很好的一致性。基因组mCH与相应簇的表达水平呈负相关,验证了作者的基于mCH标记的基因注释。
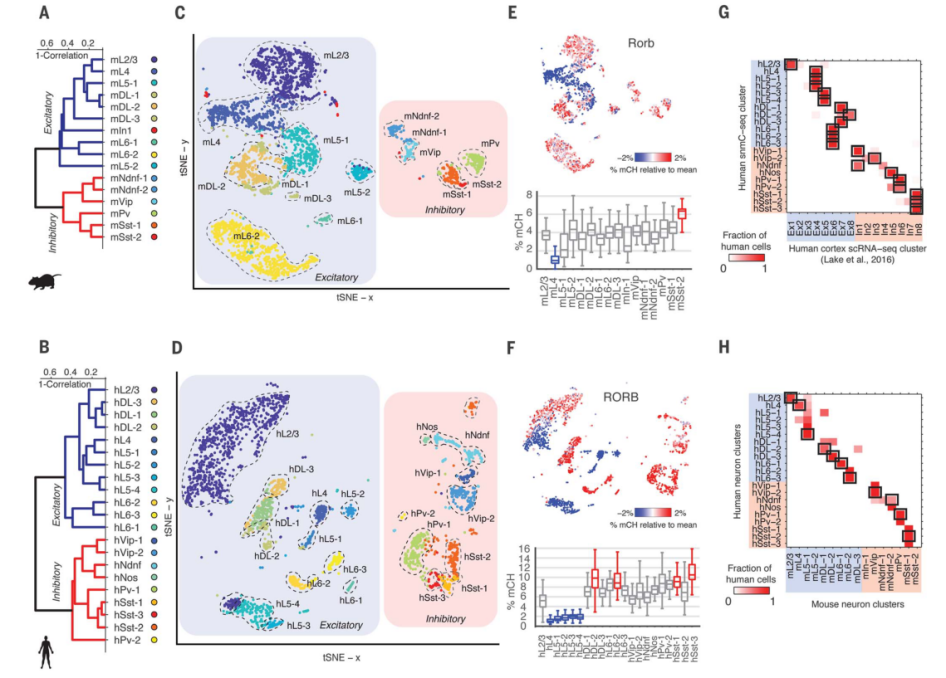 图2 非CG甲基化(mCH)特征识别小鼠和人类FC中不同的神经元群体
图2 非CG甲基化(mCH)特征识别小鼠和人类FC中不同的神经元群体
作者还通过关联同源基因上的mCH水平将同源小鼠和人类神经簇配对,并发现人FC相对于小鼠FC神经元多样性更高(图2H)。多个人类神经元簇与小鼠L5a兴奋性神经元(mL5-1)、L6a锥体神经元(mL6-2)或VIP、PV和SST抑制神经元(图2H)同源。作者在潜在的人类特异性抑制群体(hPv-2)中发现了一种独特的基因特异性mCH模式和超级增强子样的mCG特征。
单细胞甲基化分析的一个关键优势是可以直接获得绝大多数基因组(>97%)的调控信息,而不是通过RNA测序评估的。通过聚集每个簇中所有神经元的数据,作者可以在特定神经元群体中找到具有统计学意义的低mCG的差异甲基化区域(CG-DMRs),这些区域是调控元件较为可靠的标记。作者发现了575,524个小鼠(498,432个人)的CG-DMRs,平均大小为263.6个核苷酸(282.8个核苷酸),覆盖了基因组的5.8%(5.0%)(图3A)。作者还通过鉴定CG DMRS中丰富的转录因子结合的DNA基序,推测转录因子(TF)在特定神经元类型中发挥的作用(图3,B和C)。通过鉴定了几个已知的转录调控因子,观察到它们的结合序列多在人类中富含,在小鼠CG-DMRs同源簇中缺失(图C)。
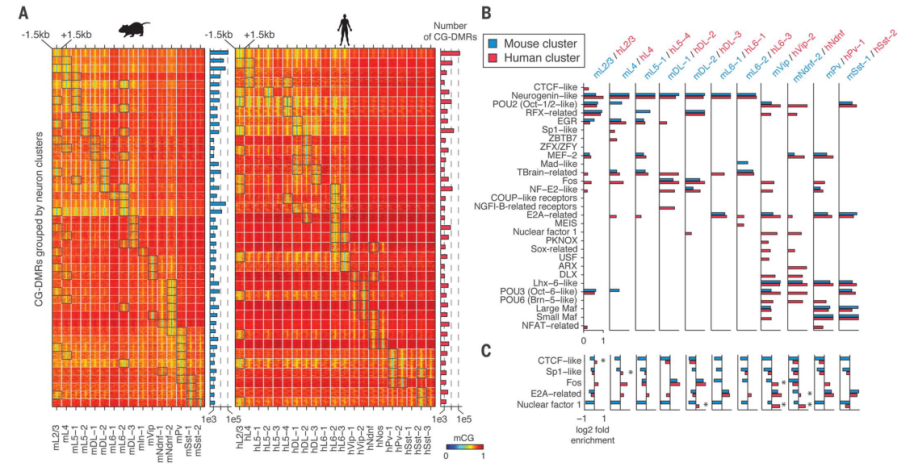 图3 保守和分化的神经元类型的特异性基因调控元件
图3 保守和分化的神经元类型的特异性基因调控元件
整体mCH和mCG水平在小鼠和人类的同源簇具有相关性(Pearson r = 0.698 for mCH, r = 0.803 for mCG; P < 0.005),表明mC的细胞类型特异性调控在进化上是保守的(图4A)。通过对12,157个同源基因对的检验,作者发现小鼠和人类同源基因簇之间的基因mCH的相关性(median Spearman r=0.236;图4,B和C)比同一物种内不同细胞类型之间的相关性(r=-0.050,小鼠;r=-0.068,人)更强。对于同源簇,作者发现了基于序列保守性共同的CG-DMR和物种特异性差异的CG-DMR。CG-DMR的mCG跨物种相关性显著大于兴奋性神经元(P<0.001,Wilcoxon秩和检验;图4D)。抑制性神经元CG-DMR较大的序列保守性可以对调节保守性进行一定的解释(P<0.001,Wilcoxon秩和检验;图4E)。以上这些研究结果支持神经元类型特异性DNA甲基化的保守性,与兴奋性神经元调节元件相比,抑制性DNA甲基化的保守性更大。
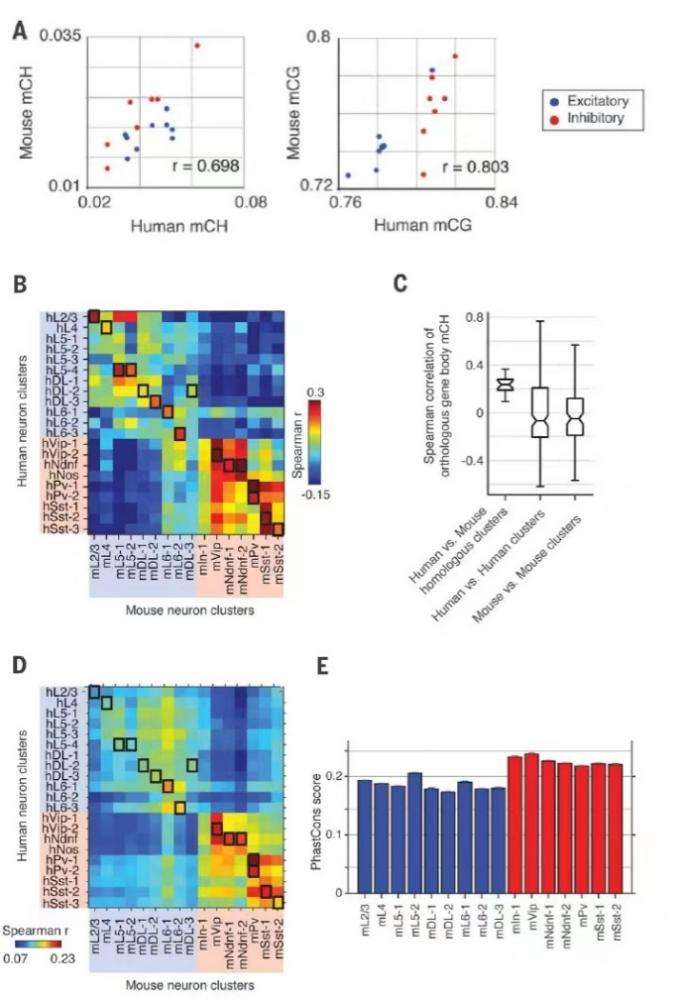 图4 基因组mCH和CG-DMRs在小鼠和人之间具有保守性
图4 基因组mCH和CG-DMRs在小鼠和人之间具有保守性
结论
本文利用单细胞DNA甲基化增加了人类神经元的多样性,同时,这些结论还需要更进一步的解剖学、生理学和功能实验来验证作者定义的基于DNA甲基化的神经元群体。单神经元表观基因组图谱可以识别基因组蛋白质编码区以外具有神经元类型特异性活动的调节元件。作者期望单细胞甲基化组方法可以应用于疾病、药物暴露或认知经验的研究,从而能够研究特定细胞类型的表观基因组改变在神经或神经精神疾病中的作用。
重点来了!
关于单细胞及微量样本DNA甲基化测序(Micro DNA-BS)
单细胞及微量样本的DNA甲基化组学研究很大程度上受制于建库技术。传统的文库构建方法或类似于基因组DNA的单细胞扩增技术很难应用到甲基化实验过程中。易基因建立了一系列微量及单细胞甲基化检测方法,可对于不同项目需求,个性化提供检测方案,在全基因组、简化基因组、靶基因等范围开展甲基化检测。
易基因建立的单细胞及微量样本DNA甲基化测序技术包括:
- 单细胞全基因组甲基化测序(scWGBS)
- 单细胞简化基因组甲基化测序(scXRBS)
- 微量样本全基因组甲基化测序(Micro DNA-WGBS)
- 微量细胞或DNA简化基因组甲基化测序(Micro DNA-XRBS)
应用方向:
单细胞及微量珍稀样本的甲基化研究主要应用于肿瘤发生机制,癌症研究,胚胎植入前诊断,胚胎早期发育,生殖细胞重组,干细胞及细胞异质性等研究领域。应用的样本包括单细胞、微量细胞、微量DNA等。特别适用于难以取得的珍稀样本和细胞异质性较大的组织样本。
技术优势:
1)微量细胞或单细胞全基因组甲基化测序(Micro DNA-WGBS)DNA起始量:
单细胞/100-1000个细胞
1ng基因组DNA
90%以上基因组CG覆盖
2)微量细胞或DNA简化基因组甲基化测序(Micro DNA-XRBS)DNA起始量:
1ng基因组DNA;
10-20M有效CG位点覆盖;
20G测序数据量。
有DNA甲基化测序或组学研究的老师,如果有相关疑问/业务咨询,欢迎留言或直接联系我们!
有DNA甲基化测序或组学研究的老师,可致电易基因0755-28317900咨询了解。
Nature | DNA甲基化测序助力人多能干细胞向胚胎全能8细胞的人工诱导
亮点研究:单细胞组学测序技术揭示水稻受精过程DNA甲基化重塑机制
单细胞甲基化测序(scBS-seq)比对率奇低?你的文库方向性参数可能没选对!
标签:DNA,Science,测序,基因组,甲基化,单细胞,神经元 来源: https://www.cnblogs.com/E-GENE/p/16355688.html